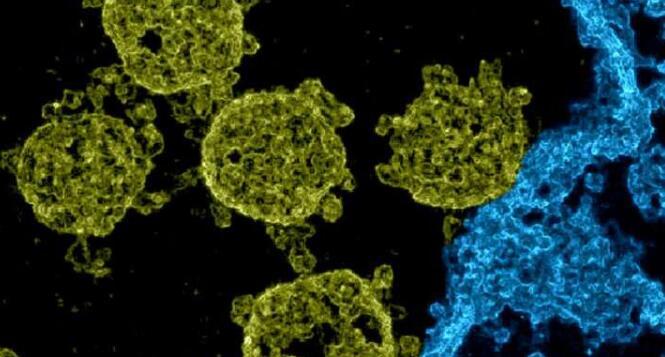
利哈伊大学的生物工程研究人员已经确定了人类细胞中的受体与SARS-CoV-2的尖峰(S)蛋白(导致的病毒)之间存在以前未知的相互作用。此新信息可能有助于开发新的策略,以阻止SARS-CoV-2进入人体细胞。
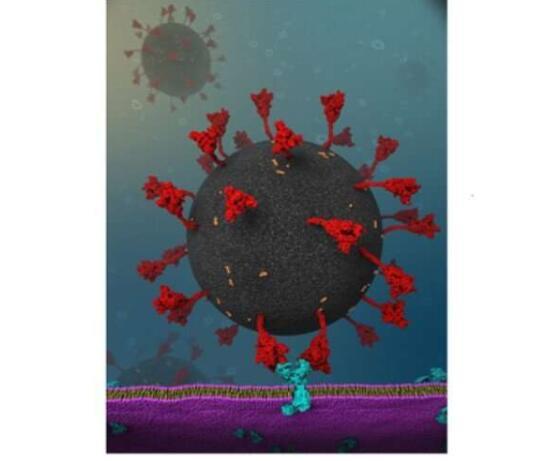
X. Frank Zhang和Wonpil Im从最近的研究中了解到,人细胞中SARS-CoV-2突突蛋白与血管紧张素转换酶2(ACE2)受体之间的相互作用要强于结构相同的SARS-C突突蛋白之间的相互作用。 CoV-1(导致2002-2004年SARS爆发的病毒)和相同的受体。
“我们的目标是鉴定SARS-CoV-2的特征并研究其在人细胞侵袭过程中的蛋白质-蛋白质相互作用,以提供更多洞察力,从而使成功进行侵袭过程的第一步成为可能,”张副教授说。 Lehigh的生物工程和机械工程与力学专业。
他们的发现发表在3月中旬刊登在《生物物理杂志》特刊“生物物理学家应对挑战I”上的一篇名为“ SARS-CoV-2尖峰RBD与人ACE2蛋白质-蛋白质相互作用的生物力学表征”的文章中。其他作者包括来自利哈伊大学的:生物工程学的曹文鹏,侯德成和金成汉;机械工程与力学专业的Chuqiao Dong ;以及来自纽约血液中心Lindsley F. Kimball研究所,Wanbo Tai和Du Lanying的人。
使用结合的单分子力谱和分子动力学模拟,Zhang和Im的团队能够识别ACE2聚糖(附着在蛋白质表面的糖基)和SARS-CoV-2尖峰之间以前未知的相互作用。这种相互作用似乎负责加强病毒-细胞相互作用。他们说,与引起2002-2004年SARS爆发的类似病毒相比,这可以部分解释的较高感染率。
“我们惊讶地发现ACE2聚糖和SARS-CoV-2突突蛋白之间的特异性相互作用使得病毒很难从细胞中分离出来,”生物工程学,计算机科学,化学教授伊姆说。和生物科学,以及里海(Lehigh)的健康,科学和工程专业指定主席。
为了得出这些发现,研究小组采用了张的创新性单分子检测技术,测量了刺突蛋白与ACE2受体相互作用的分离力。他们使用Im开发的CHARMM-GUI中可用的复杂系统的全原子分子动力学模拟,然后确定了这种相互作用中的详细结构信息。
张说:“在我们小心地去除了所有ACE2聚糖并测量了相互作用的力之后,我们发现SARS-CoV-2尖峰-ACE2相互作用的强度回落到与SARS-CoV-1相似的水平。”
张说:“与结构相似的SARS-CoV-1相互作用较弱的情况相比,这种新发现的与ACE2聚糖的相互作用可能是导致发生率更高的一个因素。” “我们希望研究人员能够利用这些信息来开发新的策略,以识别,预防,治疗和接种针对的疫苗。”
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。