TMEM16家族的膜蛋白被誉为代表难以捉摸的钙激活氯离子通道。然而,大多数家庭成员被证明是一种蛋白质,在脂质膜的两侧之间改变脂质,一些也具有非选择性离子传导性。
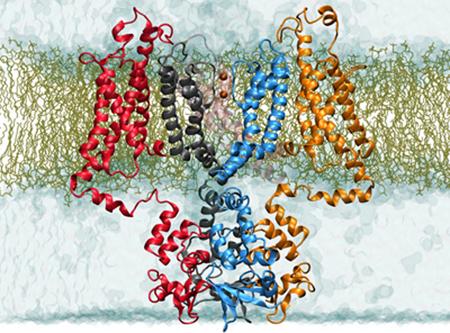
在一项关于TMEM16家族哺乳动物和真菌蛋白质的新研究中,荷兰格罗宁根大学结构生物学系的低温EM单元负责人Cristina Paulino和来自瑞士苏黎世大学的同事们显示了这些蛋白质的结构揭示了它们的功能。结果发表在3月12日的eLife期刊上的两篇背靠背论文中。
早在20世纪80年代,科学家就发现了由钙激活的特定氯离子通道。然而,直到2008年才发现这些通道的实际分子特征属于TMEM16家族。Paulino说,这些通道可用于治疗囊性纤维化,这是一种肺部和其他器官中氯离子运输失灵的疾病。随后,在人类基因组中发现了10种不同的TMEM16基因,但是当研究它们的功能时,结果令人惊讶。“两个基因确实编码了氯离子通道,但其余的是”碎屑酶“ - 在脂质双层两侧移动磷脂的蛋白质。
细胞死亡
细胞膜的脂质组成是不对称的:内单层和外单层含有不同的磷脂。通过将特定的磷脂从膜的一侧移动到另一侧,刮擦破坏了不对称性。“这可能是一个非常强烈的信号”,Paulino解释道。'例如,当位于膜内部的脂质存在于外部时,这可以作为诱导细胞死亡的信号。或者,在脂质刮擦酶TMEM16F的情况下,启动血小板中的血液凝固。因此,严格控制scramblase活动至关重要。然而,为了使事情复杂化,这些scramblase蛋白中的一些也充当非选择性离子通道。
作为Raimund Dutzler(现为她的合作者)实验室的博士后,Paulino解决了TMEM16A的低温EM结构,TMEM16A是TMEM16系列的一员,专门用作通道。当她将这种结构与真菌nhTMEM16 scramblase的X射线结构进行比较时,事情就开始发生了:'这两项研究都确定了这个双功能家族的特征。我们可以理解类似的蛋白质结构如何适应以发挥这些不同的任务。然而在脂质翻译酶的结构中,我们观察到膜跨越和膜可接近的腔,脂质可以通过该腔滑动,沟槽在氯离子通道的结构中闭合以形成允许离子扩散通过膜的孔。 “
Scramblases
然而,仍然存在很大问题:“我们想知道如何通过钙调节这些碎屑,以及它们中的一些如何同时促进离子转运。”为此,她在格罗宁根大学新成立的研究小组与瑞士苏黎世的Dutzler小组一起开始研究哺乳动物TMEM16F蛋白,该蛋白在血液凝固中起着至关重要的作用。他们在有钙和无钙的环境中解决了蛋白质的结构,以捕捉开放和闭合状态。然而,没有一种低温EM结构显示具有腔的开放状态,磷脂和离子可通过该腔传输。Paulino解释说,“含钙和不含钙的结构只有很小的差别”。
有几种可能的解释:脂质可以在没有形成水腔的情况下运输,或者实验条件对于蛋白质采用“开放”状态而言根本不是最佳的。突变对不同位置的影响使得第一种选择似乎不太可能。但要取得进展,需要更多信息。“所以我们决定回到我们对真菌nhTMEM16的研究。”
不是黑白的
这些实验证明更成功。保利诺和她的同事观察到一个开放的状态,一个可以输送磷脂的沟槽;封闭的国家;以及可以允许离子传输的中间状态。“事实上,我们发现所有三种状态都存在钙,这应该会导致开放状态。因此,我们的结果表明,该结构是高度动态的,在不同的状态之间达到平衡。它还意味着必须有一个额外的因素来调节除钙之外的TMEM16蛋白的活性,因为在细胞中这些蛋白的活性受到严格调节。
Paulino和她的同事在理解TMEM16家族的蛋白质如何运作方面取得了很大进展。“我们现在知道它不是一种黑白的情况:多种蛋白质构象处于动态平衡状态。”在完全打开状态下,它们是刮擦,而在中间状态,它们可以传输离子。这表明这些蛋白质最初是碎屑酶,但是它们中的一些进化成纯离子通道,可能是通过有利于蛋白质中间形式的突变。
动力学
需要大量的结构和功能数据来理解TMEM16蛋白的复杂作用机制。对于Paulino来说,这项研究再次证实了cryo-EM作为一种研究工具的力量:“这使我们能够对活性结构的动力学进行采样,并看到蛋白质可能存在的多种不同状态。”
标签:膜蛋白
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。