然而,一项发表在《自然通讯》上的新研究发现了胶质母细胞瘤干细胞(GSC)的一种分级层次结构,可以用来减缓肿瘤的生长,提高生存率。研究同时揭示了这种层次的可能起源,可能有助于识别癌症干细胞的特异性靶点。

一、胶质母细胞瘤
胶质母细胞瘤是除胰腺癌之外死亡率最高的癌症,肿瘤生长快、病程短、高致残,且最具侵袭性。
作为神经系统最常见的恶性肿瘤,胶质母细胞瘤的疾病进展非常迅速,且极易复发,复发率高达100%,五年生存率低于5%,被认为神经外科治疗中最棘手的难治性肿瘤之一。
胶质母细胞瘤的复杂性,使得许多传统治疗方法不适用。目前,胶质母细胞瘤术后标准治疗是替莫唑胺(Temodar)化疗和放射治疗。
不过,近年来一些新疗法的出现,如溶瘤病毒疗法、基因疗法等,有望改变胶质母细胞瘤的治疗方式。
二、“惹祸精”癌症干细胞
野生型胶质母细胞瘤,是最常见的成人原发性脑癌。经过放疗和替莫唑胺化疗后,中位复发时间仅为7个月。
这种癌症由两个主要的细胞室组成:其中较大的分化细胞室,能帮我们理解胶质母细胞瘤基因组和分子基础;还有一个较小的、特征不太明显的细胞室,具有类似干细胞的能力。

分子和基因组的异质性,以及放疗和化疗后具有干细胞样特性的癌细胞亚群的持续存在,被认为是胶质母细胞瘤治疗耐药和预后极差的主要原因。
有研究表明,GSC能抵抗放疗和替莫唑胺化疗,可能在癌症生长和复发中起作用。但目前尚无针对GSC的治疗方法。
三、胶质母细胞瘤“四胞胎”
既往研究通过对癌症基因组图谱(TCGA)里的基因组和转录分析,建立了肿瘤患者间的异质性。从主要分化细胞中提取的全肿瘤转录数据分析表明,胶质母细胞瘤主要分为4种亚型:神经原型、神经型、经典型和间充质型。
尽管转录组特征和相关的基因组改变各不相同,但这些亚型在生存率方面并没有差异。最新的研究表明,多种亚型共存于同一肿瘤的不同区域和不同细胞中,不同患者和同一患者肿瘤内的异质性,给临床研究和治疗带来很大挑战。
四、最大ScRNAseq研究
麦吉尔大学蒙特利尔神经学研究所和医院的研究小组开展了有史以来最大的单个癌细胞RNA测序(ScRNAseq)研究,包括55,000个胶质母细胞瘤细胞和20,000个正常脑细胞,并将发育中的人脑的谱系结构等级与癌细胞的转录组进行了比较。
研究人员通过ScRNAseq从16名患者中获得了53,586个细胞(平均年龄:62.3岁;25%为女性),涵盖30,205个全肿瘤细胞和23,381个GSC富集。
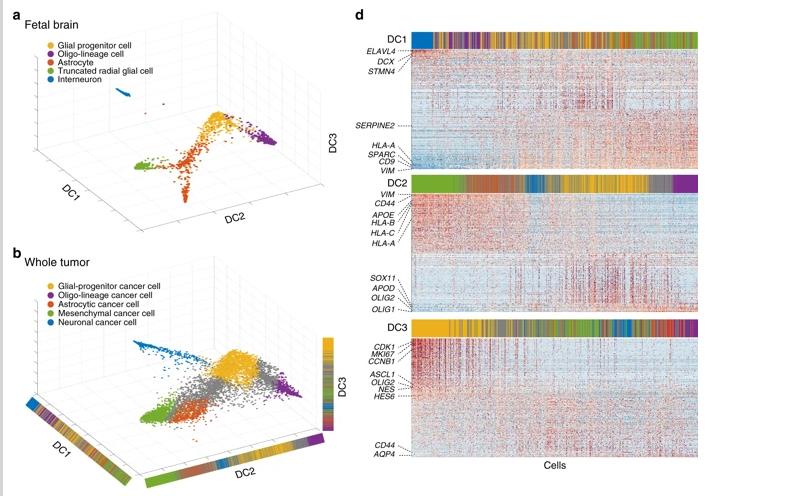
结果发现,所有其他癌细胞都是从GSC中发育出来的。尽管祖细胞GSC占肿瘤总数的比例相对较小,但分裂程度远远超过成熟的癌细胞,并且占肿瘤分裂细胞的绝大多数。
在确认了祖细胞GSC中的分子弱点后,研究人员尝试将其作为靶点,发现祖细胞GSC的存活和增殖会因此降低。而在临床前疾病模型中,这抑制了肿瘤的生长,增加了生存率。
而后研究人员构建了三维细胞层次图,其中一些快速分裂的细胞是最早可检测到的癌细胞,因此可用来识别特定GSC的治疗靶点。
五、未来治疗方向
该研究在解决胶质母细胞瘤异质性方面取得了很大进展,并提供了一个新的框架来重新考量胶质母细胞瘤的性质。
癌细胞与肿瘤微环境相互作用的机制虽然还不明确,但这项研究为胶质母细胞瘤的形成和进展指明了方向,未来有望找到靶向这些细胞的新疗法。
由于胶质母细胞瘤的异质性,患者的治疗选择通常基于二代基因测序(NGS)报告,但这些报告和信息只考虑单个畸变,而忽略了许多分子通路以及其他患者特定的多组学数据。
好医友医疗网神经肿瘤专家、哈佛医学院丹娜法伯癌症研究所神经肿瘤学中心主任、神经科教授Patrick Wen博士说:“为了改善胶质母细胞瘤患者的治疗预后,我们需要了解患者的多突变影响,这超出了当前NGS报告的分析范围。使用患者个性化的多组数据对治疗反应进行生物模拟,对胶质母细胞瘤患者而言是一个重大进步。”

好医友肿瘤治疗应答指数(TRI)通过使用多组学数据并通过个性化生物模拟模型对胶质母细胞瘤患者的治疗反应进行生物模拟,其预测的准确率远超基于NGS报告制定的治疗方案,从而降低患者治疗风险,以及因治疗失败而浪费的时间和经济成本。
通过使用创新的多组学建模、计算生物模拟和人工智能启发式技术,好医友TRI可为胶质母细胞瘤患者预测最有效的疗法。进入中国一年多来,国内已有包括胶质母细胞瘤在内的数百名肿瘤患者受益于TRI,获得了匹配的个性化治疗方案。
标签:
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。